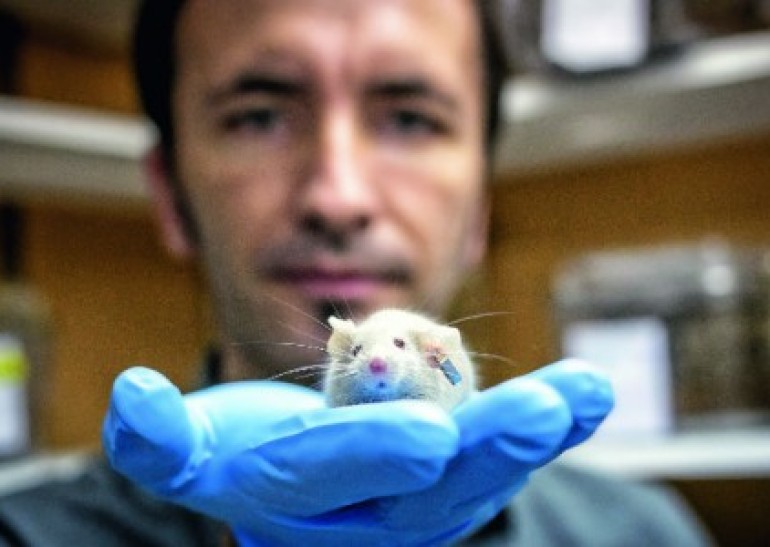
Esta historia, a fin de cuentas, es la historia de dos ratones. Uno que aprende más rápido de lo que debería y otro que no debería estar vivo. También de los que los precedieron, otros centenares que ya se transformaron en datos, observaciones, evidencias. Y de los que vienen, los más de dos mil roedores que están arriba, en el gran bioterio que construyeron hace un año, cuando ya no fueron suficientes los subterráneos de la Facultad de Medicina de la Universidad de Chile. Ratones transgénicos, con párkinson, alzhéimer, huntington, superinteligentes o incapaces de recordar lo que acaban de ver. Pero sobre todo es la historia de este ratón, que no debería estar vivo pero aquí está, intentando mantenerse en pie sobre la mano del investigador Vicente Valenzuela, de 32 años, en esta bodega bajo tierra, sellada a presión para que ni el aire pueda escapar.
Es un roedor en los huesos, retorcido, con la columna doblada en una gran joroba, que a simple vista parece lo que es: un enfermo de Esclerosis Lateral Amiotrófica (ELA), una de las enfermedades neurodegenerativas más agresivas, que en humanos tiene una esperanza de vida de tres a cinco años, y en ratones de sólo 150 días. Y ése es el punto: la tarde de este viernes, el día anterior a que lo sacrifiquen para procesar su tejido, este ratón, el último de los 80 ejemplares mutados para desarrollar ELA, ha cumplido 190 días vivo. Y más importante que eso: aunque ya sólo debería ser capaz de mover sus ojos —como Stephen Hawking, el más famoso de los enfermos de ELA—, aún es capaz de mover sus piernas. Es el mejor ejemplar de la camada a la que hace medio año, recién nacidos, se les inyectó en el cerebro un virus modificado, diseñado para que sobreexpresaran la proteína xbp-1, la encargada de echar a andar la reparación de las células sometidas a estrés, y que en caso de no lograrlo, les significa la muerte. La llave maestra del deterioro y de la resistencia a enfermedades neurodegenerativas. Una terapia génica que nunca nadie había hecho, y que podría ser la puerta para contrarrestar un mal que en el 90% de los casos ni siquiera se sabe su causa.
—Este experimento termina mañana —dice Valenzuela, en voz baja, como si no quisiera molestar al centenar de ratones que lo miran—. Hace dos años empezamos a notar que los ratones vivían más. Los mirábamos todos los días, yo venía hasta los fines de semana, y no les pasaba nada. Tenía unas hojas de cálculo enormes en que anotaba todo, y seguían viviendo, seguían viviendo, seguían viviendo. ¡Hubo ratones que vivieron más de 300 días!
El final del experimento abre una nueva etapa en la línea de terapia génica contra la ELA, uno de los frentes de avanzada del Laboratorio de Estrés Celular y Biomedicina que dirige Claudio Hetz, uno de los científicos más prolíficos del país —con 39 años, ha firmado 132 trabajos—, y referente mundial en homeostasis proteica y apoptosis: en términos simples, el equilibrio de las proteínas en las células, su alteración y el proceso de reconfiguración del genoma para repararlas o suicidarse. En ese campo escribe los reviews anuales de la serie Nature y su equipo ha logrado avances clave en párkinson y alzhéimer, pero hoy están enfocando sus esfuerzos en atacar la ELA. Y tienen los aliados necesarios: el mes pasado ganaron tres proyectos de financiamiento de la US Navy y de las dos fundaciones más grandes del mundo en el tema, la ALS Therapy Alliance y la Muscular Dystrophy Association, y están trabajando en conjunto con Robert Brown, de la U. de Massachusetts, descubridor del primer gen de la enfermedad y considerado “padre de la ELA”.
Lo que buscan ahora es aumentar la dosis, probarla en otros modelos animales, y crear un virus capaz de llevarla específicamente a las motoneuronas, las encargadas de controlar el movimiento. Esos pasos, que podrían tomar cinco años, son los que Hetz cree necesarios para hacer una prueba clínica en humanos. Brown, que cuenta con pacientes a su disposición, cree que deberían hacerla ya. Vicente Valenzuela, mesurado, dice que tienen que estar seguros, mientras toma una caja de un estante que tiene otras cien, la pone sobre una mesa y le quita la tapa. En ella, una ratona da leche a una decena de crías, a las que en la mañana él mismo les inyectó en el cerebro un virus con una mayor concentración de xbp-1. La idea es comprobar si con el doble, la sobrevida aumenta al doble, un paso clave en la terapia.
Mientras observa a sus ratones, en el piso de arriba, el investigador brasileño Danilo Medinas hace pruebas en otro foco terapéutico: manipular los sensores de estrés de las neuronas para que aumenten su nivel de tolerancia a la ELA sin suicidarse. Gabriela Martínez, en el bioterio, hace pruebas en laberintos para comprobar cuán inteligentes se están volviendo sus ratones. El teléfono del laboratorio suena seguido, y a veces son enfermos de ELA que quieren conseguir trehalosa, un azúcar capaz de generar autofagia, es decir, hacer que el cerebro se alimente de los cúmulos de proteínas que genera la enfermedad. Hetz publicó ese descubrimiento en Genes and Development en 2009, y aunque aún no hacen una prueba clínica, en internet ya hay varios foros donde pacientes la comercializan y discuten las dosis que les han dado mejor resultado.
En su oficina, Claudio Hetz suele contestar esas llamadas desesperadas, aunque cada vez tiene menos tiempo. En los últimos meses el laboratorio ha entrado en ebullición, sobre todo a partir de la mañana, hace dos meses, en que reunió a su equipo y les dijo algo que nunca pensó que diría: que habían dado con la tecla.
Que iban a curar la ELA.
LA MENTE DE UN RATÓN
El laboratorio es amplio y está dividido en cuatro mesones: uno para estudios celulares, otro para párkinson, otro para alzhéimer, y otro para la ELA. Claudio Hetz, codirector del Instituto de Neurociencia Bioemédica, que agrupa a once laboratorios, sale de su oficina, dominada por un gran cuadro de John Coltrane y por un tocadiscos con vinilos de jazz, y camina por entre los mesones, observando. Con pantalones pitillo, zapatillas y camisa afuera, vestido de negro, parece menos científico que guitarrista de La Nave, la banda de rock experimental que lidera en sus tiempos libres. Sobre un mesón, dos estudiantes llevan horas tomando con pinceles finas, casi imperceptibles láminas de cerebro de ratón, y colocándolas con delicada paciencia sobre muestrarios.
Al fondo, en un cuarto completamente oscuro, Gabriela Martínez, de 32 años, observa videos. Lo que ve son cientos de versiones de la misma película: un ratón cae a una piscina llena de agua y tiene un minuto para encontrar la rampa que lo salvará. En las orillas hay señales visuales para que pueda recordar, pero la plataforma cambia de lugar y debe entender esos cambios. En la pantalla están las trayectorias de 80 ratones, cada uno repitiendo el proceso hasta quince veces, y las diferencias son evidentes: mientras algunos dan vueltas por la piscina sin ningún rumbo, otros dudan y luego se orientan, y un tercer grupo, los que importan, a los pocos intentos ya van directo a ella. Son las diferencias que han ido notando entre los ratones que han generado sin xbp-1 en el cerebro, los controles, y los ratones con sobreexpresión de la proteína, los superinteligentes.
El camino del descubrimiento, que tienen patentado y publicarán el próximo mes en la revista Cell Report, comenzó en 2007, cuando Hetz recién había regresado de hacer su posdoctorado en Harvard, y estaba obsesionado por entender el rol de xbp-1 en el cerebro, en condiciones normales. Acababa de publicar un paper revolucionario en Nature junto a Stanley Korsmeyer, el descubridor del primer gen que regula la apoptosis —el suicidio de las células ante el estrés—, en donde demostraron que las mismas proteínas encargadas de reparar las células ante el estrés eran las que las asesinaban. Tras ese golpe, Hetz, con 28 años, pasó a trabajar con Laurie Glimcher, hoy decana de Medicina en Cornell y descubridora de xbp-1, quien le permitió utilizar un ratón genéticamente deficiente que acaba de crear, para que apagara esa proteína en el sistema nervioso y midiera sus resultados frente al estrés.
En 2009, poco después de que el neurocientífico volviera a Chile, Gabriela Martínez llegó a su laboratorio, y lo que le pidieron, que midiera la relación de xbp-1 con memoria y aprendizaje, la llevó por el mundo: las primeras pruebas las hizo en la Universidad Católica, pero luego se fue a perfeccionarlas a Harvard, y más tarde a Valparaíso, a realizar con el Centro Interdisciplinario de Neurociencias pruebas de inteligencia en laberintos. En ese tiempo, solía hacer viajes semanales desde Santiago con 60 ratones transgénicos en el auto. El periplo terminó recién el mes pasado, cuando las pruebas estuvieron listas, pero la US Navy, con quienes venía teniendo reuniones hace meses, financiará una segunda etapa del proceso los próximos tres años.
—Llegamos a que xbp-1 regula un gen que se llama bdnf, y esa proteína es un gen maestro del desarrollo del cerebro —dice Gabriela Martínez—. Si le aumentas la expresión, mejora el aprendizaje, pero nunca fue la idea generar ratones superinteligentes, es un asunto complejo éticamente si se piensa para humanos.
Claudio Hetz no esquiva el tema: reconoce que una de las primeras cosas que le preguntaron los marinos norteamericanos fue si con esta línea algún día podrían hacer supersoldados. Él les respondió que lo suyo era ciencia básica, pero que tal vez algún día podría generar personas que aprendieran más rápido.
—Yo, como científico, no me puedo inhibir de responder preguntas biológicas por un problema ético —dice Hetz—. Obviamente lo hay: podríamos hablar de generar superpersonas, mejorar la raza. Inicialmente me lo cuestioné, pero nuestro estudio no va a tener aplicaciones directas, sólo conocimiento sobre cómo se generan los recuerdos. Y cómo aplicarlo en el alzhéimer.
La idea inicial fue ésa: comprobado el doble efecto de xbp-1, mejorar el equilibrio de proteínas —la homeostasis proteica— y potenciar la sinapsis, consiguieron fondos de la Alzheimer Asociation para probar el impacto en daño neurodegenerativo. Pero pronto entendieron que donde tenían más armas era en la ELA: ya estaban teniendo resultados alterando el sensor de estrés, habían hecho algunas pruebas de xbp-1 y tenían la trehalosa. También a Robert Brown, con su experiencia en virus y su campo clínico de pacientes, y lo más importante: los modelos de ratones que desarrollaban la enfermedad de forma casi idéntica a un ser humano, con los mismos síntomas y casi igual cronología.
Pronto empezarían a vivir más de lo pensado.
LA CURA DE LA ELA
Curar la ELA, por supuesto, no es fácil. Hasta el año pasado se conocían los genes responsables del 10% de los casos, pero el resto, personas sin predisposición genética conocida, no se sabía por qué la desarrollaban. Pero el año pasado, el descubrimiento en Estados Unidos de un nuevo gen mutante, c-9orf72, asociado al 40% de los casos, abrió una gran puerta para buscar una cura transversal, y les dio un fuerte impulso. Aparte de la trehalosa y la terapia génica de xbp-1, ambas patentadas, el grupo apostó por desarrollar una tercera línea, liderada por Danilo Medinas, de 34 años, anclada en el área de mayor expertise del laboratorio: la decisión de las células de repararse o suicidarse frente al estrés. Medinas lo explica así: el retículo endoplasmático de una célula es la fábrica de proteínas, una suerte de cinta de transmisión, donde se elige lo que sirve y lo que se desecha. Cuando la fábrica comienza a incendiarse, el sensor de alarma de la célula, llamado IRE1, avisa a xbp-1 para que apague el fuego. Si IRE1 ve que xbp-1 no es capaz de controlarlo, toma la última medida: activa la autodestrucción de la célula. Ese proceso, generado en las neuronas responsables del movimiento normalmente en la vejez, es lo que va matando a un cerebro enfermo de ELA. Una forma de combatirlo es llamar a más refuerzos externos —inyectar xbp-1—, y la otra es hacer que IRE1 no se asuste ante el fuego.
En esa línea también han tenido resultados importantes en ratones, aumentándoles su resistencia ante la ELA, y hoy están estudiando con Robert Brown la posibilidad de crear un fármaco que ataque directamente los sensores de IRE1, en un estado más avanzado de la enfermedad, financiados por la Muscular Dystrophy Association y la US Force. Si logran llevar esa estrategia hasta un ensayo clínico, creen que podrían aumentar tanto la sobrevida como la calidad de vida de los enfermos.
—Podríamos pensar en duplicarles la vida —dice Danilo Medinas—, ya tenemos el conocimiento y tenemos que desarrollar la tecnología. La potencia de lo que estamos haciendo en el laboratorio tiene que ver con que trabajamos en distintos genes mutantes, buscando terapias transversales. Por eso lo estudiamos de manera tan amplia, porque necesitamos todas las armas posibles.
Hace dos meses, Claudio Hetz los reunió en el laboratorio, emocionado, y les dijo lo que un científico rara vez dice: que iban a llegar a una cura. Que lideraban el conocimiento sobre homeostasis, que tenían todas las herramientas y los contactos en EE.UU. para probarlas sin necesidad de vender la patente. Que lo iban a lograr, que iban a curar la ELA. El equipo lo miró sorprendido.
El próximo mes, va a publicar con Robert Brown un paper en EMBO Journal que aumentará la expectativa por lo que tienen en las manos: luego de secuenciar a cien pacientes con ELA, les descubrieron en común una alteración en las proteínas encargadas de controlar la homeostasis proteica. Es decir, que el equilibrio de las proteínas en la célula podría ser no sólo una consecuencia, sino una causa de la enfermedad. En septiembre, los dos científicos se juntaron en Massachusetts para analizar los resultados de la terapia génica. Brown le preguntó qué estaban esperando para probarlo en humanos, pero Hetz le respondió que primero tenían que afinar todos sus descubrimientos. Le dijo que no quería curar al 2% de los enfermos de ELA, sino lograr una cura transversal.
—¿De verdad crees que vas a curar la ELA?
—Si logramos hacer una terapia génica en humanos, vamos a curar la ELA. Hemos sido pioneros, tenemos las herramientas, tenemos las alianzas para llegar al paciente, y el efecto que tuvimos en expectativa de vida es el más grande descrito. Nos acabamos de ganar tres proyectos de financiamiento. Si me preguntabas hace tres años no te lo hubiera dicho, pero es distinto cuando crees que encontraste algo importante y que tú lo vas a hacer. Ya no hay excusas.
—¿Qué sientes ante eso?
—Cuando reuní a mi equipo y les dije que íbamos a curar la ELA, estaba muy emocionado, nunca había sentido algo así. Es como mucho, ¿no? No es una anécdota más de una de las miles de cosas que les pasan a las motoneuronas. Pero está ahí, tenemos la oportunidad y vemos la ventana. Sólo hay que hacer los experimentos correctos.
Por Nicolás Alonso
Fuente: Revista Qué Pasa


¿Quieres dejar un comentario?