Biovoces
Combatiendo el cáncer con nuestro sistema inmune
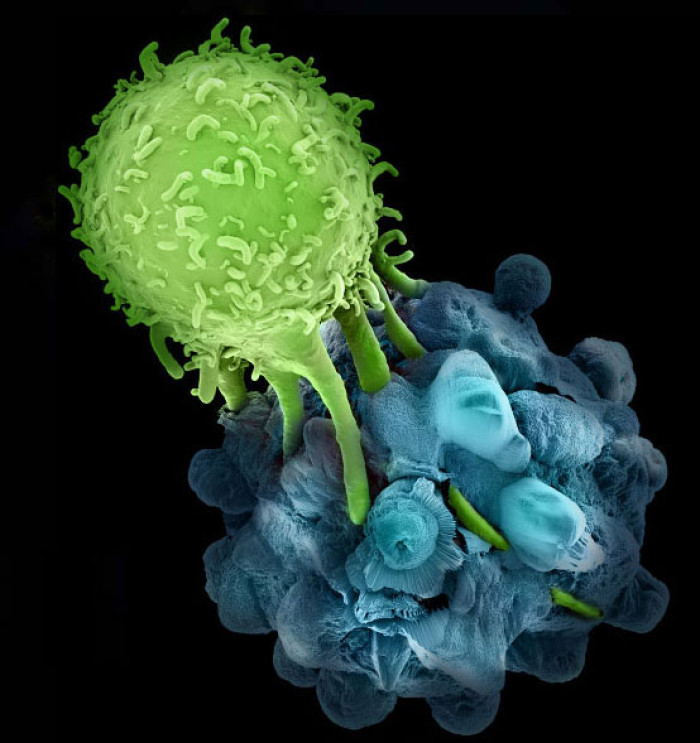
Los avances de la biomedicina han, sin duda, cambiado el curso de nuestras vidas y lo harán aún más en el futuro. Desde que desarrollamos las primeras vacunas hace más de un siglo, el poder del sistema inmune ha guiado a quienes desarrollan la biomedicina. Esto nos ha permitido ganar la batalla contra un gran número de patógenos microscópicos, algunos de ellos siendo virtualmente extinguidos. Esto también ha incidido en un aumento dramático en la expectativa de vida y en el aumento de otras enfermedades relacionadas con la edad, entre ellas el cáncer.
Aunque el potencial del sistema inmune para combatir el cáncer fue observado hace decenas de años, sólo recientemente es que se ha logrado un mejor entendimiento de la interrelación entre tumores y el sistema inmune. Esto nos ha permitido comenzar a liberar el poder del sistema inmune en contra del cáncer. Los primeros intentos se basaron en desarrollar vacunas y estrategias para que las células presentadoras de antígenos activaran a los soldados del sistema inmune, los linfocitos T, y así crear verdaderos ejércitos capaces de eliminar a las células tumorales.
Es así como en 2010 la FDA (U.S. Food and Drug Administration) aprobó la primera inmunoterapia antitumoral comercializable, Sipuleucel-T, la cual se basa en el uso de células presentadoras de antígeno aisladas del paciente y cargadas con un antígeno de cáncer prostático. Sin embargo, su eficacia es limitada, ya que logra prolongar sólo cuatro meses la vida de los pacientes a un costo económico elevado. A nivel global muy pocos pacientes han mostrado un beneficio clínico objetivo en estudios clínicos usando vacunas antitumorales. La baja eficacia de las vacunas en cáncer se debe a la baja frecuencia de linfocitos T antitumorales capaces de reconocer con alta afinidad las células tumorales, ya que el sistema inmune está diseñado para no atacar a las células propias.
Estudios recientes han reafirmado esta conclusión al demostrar que la respuesta de linfocitos T que atacan al tumor espontáneamente está dirigida contra antígenos nuevos resultantes de mutaciones en el genoma de las células tumorales. Es así como la administración de linfocitos T antitumorales amplificados desde biopsias ha demostrado su eficacia para eliminar tumores en pacientes con melanoma metastásico, neuroblastoma y otros. La principal limitación de esta estrategia es la necesidad de obtener una biopsia suficientemente grande que permita la expansión de linfocitos T antitumorales normalmente presentes en baja frecuencia. Esta limitación ha sido resuelta mediante la terapia génica, ya que permite insertar receptores que reconocen con alta afinidad los antígenos tumorales a los linfocitos T obtenidos de la sangre. Esta estrategia para redireccionar su especificidad de los linfocitos T en contra de los tumores ha demostrado ser segura y eficaz en pacientes con melanoma metastásico, leucemias y otros.
Independientemente de la forma que se escoja para amplificar estos ejércitos de linfocitos T antitumorales, los tumores sólidos que se manifiestan clínicamente, comúnmente poseen la capacidad de evadir o suprimir la respuesta inmune mediada por linfocitos T. Uno de estos mecanismos incluye la expresión de ciertas moléculas en la superficie de las células tumorales para estimular receptores inhibitorios (tales, como CTLA4 y PD-1) en la superficie de los linfocitos T. Esto prácticamente es como apretar el botón “off” en nuestro ejército de linfocitos T antitumorales. Sin embargo, los científicos desarrollaron anticuerpos monoclonales, que son armas teledirigidas de alta especificidad, que impiden que los tumores apaguen a los linfocitos T antitumorales. Numerosos anticuerpos monoclonales que apuntan a bloquear las señales vía CTLA4, PD-1 y otros receptores inhibitorios, están actualmente en pruebas clínicas demostrado su eficacia a través de la reducción e incluso remisión de tumores en pacientes con melanoma metastásico, cáncer de pulmón, cáncer renal, entre otros.
Actualmente hay disponibles en el mercado un anticuerpo bloqueante de CTLA4 (ipilimumab) y dos anticuerpos bloqueantes de PD-1 (nivolumab y pembrolizumab) para su uso en melanoma metastásico y cáncer de pulmón. Numerosos estudios clínicos están siendo llevados a cabo para ampliar su uso a otros tipos de cáncer. En resumen estamos presenciando el surgimiento de una nueva forma de tratar el cáncer, no atacándolo directamente con drogas citotóxicas que conllevan una serie de efectos secundarios adversos, si no que liberando el poder de ejércitos de linfocitos T que pueden eliminar específicamente las células tumorales sin dañar a las células normales.
Sobre el autor
Álvaro Lladser
Investigador Principal, Laboratorio de Inmunoterapia Génica, Fundación Ciencia & Vida
Bioquímico, Doctor en Ciencias Biomédicas formado en la Universidad de Chile. Realizó su postdoctorado en el Karolinska Institutet desarrollando nuevas vacunas antitumorales. En 2011, el Dr. Lladser estableció su grupo de investigación en la Fundación Ciencia & Vida que se centra en la comprensión de los mecanismos moleculares y celulares que llevan a la activación de linfocitos T CD8+ citotóxicos.
Combatiendo el cáncer con nuestro sistema inmune

Los avances de la biomedicina han, sin duda, cambiado el curso de nuestras vidas y lo harán aún más en el futuro. Desde que desarrollamos las primeras vacunas hace más de un siglo, el poder del sistema inmune ha guiado a quienes desarrollan la biomedicina. Esto nos ha permitido ganar la batalla contra un gran número de patógenos microscópicos, algunos de ellos siendo virtualmente extinguidos. Esto también ha incidido en un aumento dramático en la expectativa de vida y en el aumento de otras enfermedades relacionadas con la edad, entre ellas el cáncer.
Aunque el potencial del sistema inmune para combatir el cáncer fue observado hace decenas de años, sólo recientemente es que se ha logrado un mejor entendimiento de la interrelación entre tumores y el sistema inmune. Esto nos ha permitido comenzar a liberar el poder del sistema inmune en contra del cáncer. Los primeros intentos se basaron en desarrollar vacunas y estrategias para que las células presentadoras de antígenos activaran a los soldados del sistema inmune, los linfocitos T, y así crear verdaderos ejércitos capaces de eliminar a las células tumorales.
Es así como en 2010 la FDA (U.S. Food and Drug Administration) aprobó la primera inmunoterapia antitumoral comercializable, Sipuleucel-T, la cual se basa en el uso de células presentadoras de antígeno aisladas del paciente y cargadas con un antígeno de cáncer prostático. Sin embargo, su eficacia es limitada, ya que logra prolongar sólo cuatro meses la vida de los pacientes a un costo económico elevado. A nivel global muy pocos pacientes han mostrado un beneficio clínico objetivo en estudios clínicos usando vacunas antitumorales. La baja eficacia de las vacunas en cáncer se debe a la baja frecuencia de linfocitos T antitumorales capaces de reconocer con alta afinidad las células tumorales, ya que el sistema inmune está diseñado para no atacar a las células propias.
Estudios recientes han reafirmado esta conclusión al demostrar que la respuesta de linfocitos T que atacan al tumor espontáneamente está dirigida contra antígenos nuevos resultantes de mutaciones en el genoma de las células tumorales. Es así como la administración de linfocitos T antitumorales amplificados desde biopsias ha demostrado su eficacia para eliminar tumores en pacientes con melanoma metastásico, neuroblastoma y otros. La principal limitación de esta estrategia es la necesidad de obtener una biopsia suficientemente grande que permita la expansión de linfocitos T antitumorales normalmente presentes en baja frecuencia. Esta limitación ha sido resuelta mediante la terapia génica, ya que permite insertar receptores que reconocen con alta afinidad los antígenos tumorales a los linfocitos T obtenidos de la sangre. Esta estrategia para redireccionar su especificidad de los linfocitos T en contra de los tumores ha demostrado ser segura y eficaz en pacientes con melanoma metastásico, leucemias y otros.
Independientemente de la forma que se escoja para amplificar estos ejércitos de linfocitos T antitumorales, los tumores sólidos que se manifiestan clínicamente, comúnmente poseen la capacidad de evadir o suprimir la respuesta inmune mediada por linfocitos T. Uno de estos mecanismos incluye la expresión de ciertas moléculas en la superficie de las células tumorales para estimular receptores inhibitorios (tales, como CTLA4 y PD-1) en la superficie de los linfocitos T. Esto prácticamente es como apretar el botón “off” en nuestro ejército de linfocitos T antitumorales. Sin embargo, los científicos desarrollaron anticuerpos monoclonales, que son armas teledirigidas de alta especificidad, que impiden que los tumores apaguen a los linfocitos T antitumorales. Numerosos anticuerpos monoclonales que apuntan a bloquear las señales vía CTLA4, PD-1 y otros receptores inhibitorios, están actualmente en pruebas clínicas demostrado su eficacia a través de la reducción e incluso remisión de tumores en pacientes con melanoma metastásico, cáncer de pulmón, cáncer renal, entre otros.
Actualmente hay disponibles en el mercado un anticuerpo bloqueante de CTLA4 (ipilimumab) y dos anticuerpos bloqueantes de PD-1 (nivolumab y pembrolizumab) para su uso en melanoma metastásico y cáncer de pulmón. Numerosos estudios clínicos están siendo llevados a cabo para ampliar su uso a otros tipos de cáncer. En resumen estamos presenciando el surgimiento de una nueva forma de tratar el cáncer, no atacándolo directamente con drogas citotóxicas que conllevan una serie de efectos secundarios adversos, si no que liberando el poder de ejércitos de linfocitos T que pueden eliminar específicamente las células tumorales sin dañar a las células normales.

Los avances de la biomedicina han, sin duda, cambiado el curso de nuestras vidas y lo harán aún más en el futuro. Desde que desarrollamos las primeras vacunas hace más de un siglo, el poder del sistema inmune ha guiado a quienes desarrollan la biomedicina. Esto nos ha permitido ganar la batalla contra un gran número de patógenos microscópicos, algunos de ellos siendo virtualmente extinguidos. Esto también ha incidido en un aumento dramático en la expectativa de vida y en el aumento de otras enfermedades relacionadas con la edad, entre ellas el cáncer.
Aunque el potencial del sistema inmune para combatir el cáncer fue observado hace decenas de años, sólo recientemente es que se ha logrado un mejor entendimiento de la interrelación entre tumores y el sistema inmune. Esto nos ha permitido comenzar a liberar el poder del sistema inmune en contra del cáncer. Los primeros intentos se basaron en desarrollar vacunas y estrategias para que las células presentadoras de antígenos activaran a los soldados del sistema inmune, los linfocitos T, y así crear verdaderos ejércitos capaces de eliminar a las células tumorales.
Es así como en 2010 la FDA (U.S. Food and Drug Administration) aprobó la primera inmunoterapia antitumoral comercializable, Sipuleucel-T, la cual se basa en el uso de células presentadoras de antígeno aisladas del paciente y cargadas con un antígeno de cáncer prostático. Sin embargo, su eficacia es limitada, ya que logra prolongar sólo cuatro meses la vida de los pacientes a un costo económico elevado. A nivel global muy pocos pacientes han mostrado un beneficio clínico objetivo en estudios clínicos usando vacunas antitumorales. La baja eficacia de las vacunas en cáncer se debe a la baja frecuencia de linfocitos T antitumorales capaces de reconocer con alta afinidad las células tumorales, ya que el sistema inmune está diseñado para no atacar a las células propias.
Estudios recientes han reafirmado esta conclusión al demostrar que la respuesta de linfocitos T que atacan al tumor espontáneamente está dirigida contra antígenos nuevos resultantes de mutaciones en el genoma de las células tumorales. Es así como la administración de linfocitos T antitumorales amplificados desde biopsias ha demostrado su eficacia para eliminar tumores en pacientes con melanoma metastásico, neuroblastoma y otros. La principal limitación de esta estrategia es la necesidad de obtener una biopsia suficientemente grande que permita la expansión de linfocitos T antitumorales normalmente presentes en baja frecuencia. Esta limitación ha sido resuelta mediante la terapia génica, ya que permite insertar receptores que reconocen con alta afinidad los antígenos tumorales a los linfocitos T obtenidos de la sangre. Esta estrategia para redireccionar su especificidad de los linfocitos T en contra de los tumores ha demostrado ser segura y eficaz en pacientes con melanoma metastásico, leucemias y otros.
Independientemente de la forma que se escoja para amplificar estos ejércitos de linfocitos T antitumorales, los tumores sólidos que se manifiestan clínicamente, comúnmente poseen la capacidad de evadir o suprimir la respuesta inmune mediada por linfocitos T. Uno de estos mecanismos incluye la expresión de ciertas moléculas en la superficie de las células tumorales para estimular receptores inhibitorios (tales, como CTLA4 y PD-1) en la superficie de los linfocitos T. Esto prácticamente es como apretar el botón “off” en nuestro ejército de linfocitos T antitumorales. Sin embargo, los científicos desarrollaron anticuerpos monoclonales, que son armas teledirigidas de alta especificidad, que impiden que los tumores apaguen a los linfocitos T antitumorales. Numerosos anticuerpos monoclonales que apuntan a bloquear las señales vía CTLA4, PD-1 y otros receptores inhibitorios, están actualmente en pruebas clínicas demostrado su eficacia a través de la reducción e incluso remisión de tumores en pacientes con melanoma metastásico, cáncer de pulmón, cáncer renal, entre otros.
Actualmente hay disponibles en el mercado un anticuerpo bloqueante de CTLA4 (ipilimumab) y dos anticuerpos bloqueantes de PD-1 (nivolumab y pembrolizumab) para su uso en melanoma metastásico y cáncer de pulmón. Numerosos estudios clínicos están siendo llevados a cabo para ampliar su uso a otros tipos de cáncer. En resumen estamos presenciando el surgimiento de una nueva forma de tratar el cáncer, no atacándolo directamente con drogas citotóxicas que conllevan una serie de efectos secundarios adversos, si no que liberando el poder de ejércitos de linfocitos T que pueden eliminar específicamente las células tumorales sin dañar a las células normales.
Sobre el autor
Álvaro Lladser
Investigador Principal, Laboratorio de Inmunoterapia Génica, Fundación Ciencia & Vida
Bioquímico, Doctor en Ciencias Biomédicas formado en la Universidad de Chile. Realizó su postdoctorado en el Karolinska Institutet desarrollando nuevas vacunas antitumorales. En 2011, el Dr. Lladser estableció su grupo de investigación en la Fundación Ciencia & Vida que se centra en la comprensión de los mecanismos moleculares y celulares que llevan a la activación de linfocitos T CD8+ citotóxicos.
Otras biovoces destacadas
Suscribete a nuestro newsletter



¿Quieres dejar un comentario ?